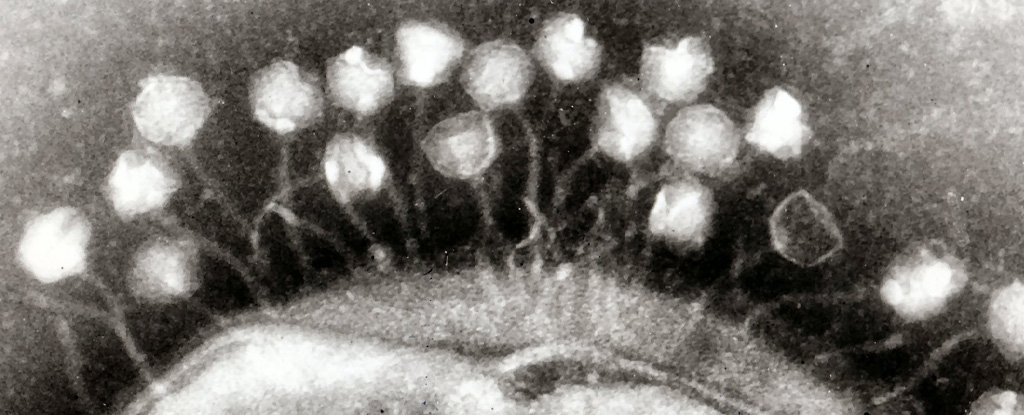
Investigación publicada hoy en Microbiología de la naturaleza ha identificado 54,118 especies de virus que viven en el intestino humano, el 92 por ciento de las cuales eran desconocidas anteriormente.
Pero como descubrimos nosotros y nuestros colegas del Instituto Conjunto del Genoma y la Universidad de Stanford en California, la gran mayoría de estos eran bacteriófagos, o “fagos” para abreviar. Estas virus “comen” bacterias y no pueden atacar las células humanas.
Cuando la mayoría de nosotros pensamos en virus, pensamos en organismos que infectan nuestras células con enfermedades como paperas, sarampión o, más recientemente, COVID-19. Sin embargo, hay una gran cantidad de estos parásitos microscópicos en nuestros cuerpos, principalmente en nuestro intestino, que se dirigen a los microbios que viven allí.
Todo el mundo hace caca (pero no todas las cacas son iguales)
Recientemente ha habido mucho interés en la microbioma intestinal humano: la colección de microorganismos que viven en nuestro intestino.
Además de ayudarnos a digerir nuestros alimentos, estos microbios tienen muchas otras funciones importantes. Nos protegen contra las bacterias patógenas, modulan nuestro bienestar mental, preparan nuestro sistema inmunológico cuando somos niños y tienen un papel continuo en la regulación inmunológica hasta la edad adulta.
Es justo decir que el intestino humano es ahora el ecosistema microbiano mejor estudiado del planeta. Aún más de 70 por ciento de las especies microbianas que viven allí aún no se han cultivado en el laboratorio.
Sabemos esto porque podemos acceder a los planos genéticos del microbioma intestinal a través de un enfoque conocido como metagenómica. Esta es una técnica poderosa mediante la cual el ADN se extrae directamente de un entorno y se secuencia al azar, lo que nos da una instantánea de lo que está presente en el interior y lo que podría estar haciendo.
Los estudios metagenómicos han revelado hasta dónde tenemos que llegar todavía para catalogar y aislar todas las especies microbianas en el intestino humano, e incluso más en lo que respecta a los virus.
11,810 muestras de caca
En nuestra nueva investigación, nosotros y nuestros colegas extrajimos de forma computacional secuencias virales de 11,810 metagenomas fecales disponibles públicamente, tomados de personas en 24 países diferentes. Queríamos tener una idea de hasta qué punto los virus se han instalado en el intestino humano.
Este esfuerzo dio como resultado el catálogo Metagenomic Gut Virus, el mayor recurso de este tipo hasta la fecha. Este catálogo comprende 189.680 genomas virales que representan más de 50.000 especies virales distintas.
Sorprendentemente (pero quizás predeciblemente), más del 90 por ciento de estas especies virales son nuevas para la ciencia. En conjunto, codifican más de 450.000 proteínas distintas, una enorme reserva de potencial funcional que puede ser beneficiosa o perjudicial para sus huéspedes microbianos y, a su vez, humanos.
También profundizamos en subespecies de diferentes virus y encontramos que algunos mostraban patrones geográficos sorprendentes en los 24 países encuestados.
Por ejemplo, una subespecie del enigmático y recientemente descrito crAssphage prevalecía en Asia, pero era poco común o estaba ausente en muestras de Europa y América del Norte. Esto puede deberse a la expansión localizada de este virus en poblaciones humanas específicas.
Una de las funciones más comunes que descubrimos en nuestro viaje de campo molecular fueron los retroelementos generadores de diversidad (DGR). Se trata de una clase de elementos genéticos que mutan genes diana específicos para generar variaciones que pueden ser beneficiosas para el huésped. En el caso de los DGR en virus, esto puede ayudar en la carrera armamentista evolutiva en curso con sus huéspedes bacterianos.
Curiosamente, encontramos que un tercio de las proteínas codificadas por virus más comunes tienen funciones desconocidas, incluidos más de 11.000 genes relacionados lejanamente con las “beta-lactamasas”, que permiten la resistencia a antibióticos como la penicilina.
Vincular los virus intestinales a sus huéspedes microbianos
Una vez identificados los fagos, nuestra siguiente tarea fue vincularlos a sus huéspedes microbianos. CRISPR, mejor conocidos por sus múltiples aplicaciones en la edición de genes, son los sistemas inmunológicos bacterianos que “recuerdan” infecciones virales pasadas y evitan que vuelvan a ocurrir.
Lo hacen copiando y almacenando fragmentos del virus invasor en sus propios genomas, que luego pueden usarse para atacar y destruir específicamente el virus en encuentros futuros.
Usamos este registro de ataques pasados para vincular muchas de las secuencias virales a sus huéspedes en el ecosistema intestinal. Como era de esperar, las especies virales muy abundantes se vincularon a especies bacterianas muy abundantes en el intestino, en su mayoría pertenecientes a los phyla bacterianos Firmicutes y Bacteroidota.
Entonces, ¿qué podemos hacer con toda esta nueva información? Una aplicación prometedora de un inventario de virus intestinales y sus huéspedes es la terapia con fagos. Terapia de fagos es un concepto antiguo anterior a los antibióticos, en el que los virus se utilizan para atacar selectivamente patógenos bacterianos con el fin de tratar infecciones.
Ha habido discusión de la posibilidad de personalizar los microbiomas intestinales de las personas mediante intervenciones dietéticas, probióticos, prebióticos o incluso “transpoosions” (trasplantes de microbiota fecal), para mejorar la salud de un individuo.
La terapia con fagos puede ser una adición útil a este objetivo, al agregar precisión a nivel de especies o incluso subespecies a la manipulación del microbioma. Por ejemplo, el patógeno bacteriano Clostridioides difficile (o Cdiff para abreviar) es una de las principales causas de diarrea adquirida en el hospital que podría ser el objetivo específico de los fagos.
Se puede lograr una manipulación más sutil de poblaciones bacterianas no patógenas en el intestino mediante la terapia con fagos. Un compendio completo de virus intestinales es un primer paso útil para estos objetivos aplicados.
Sin embargo, vale la pena señalar que las proyecciones de nuestros datos sugieren que solo hemos investigado una fracción de la diversidad viral intestinal total. Así que todavía nos queda un largo camino por recorrer.
Philip Hugenholtz, Catedrático de Microbiología, Facultad de Química y Biociencias Moleculares, La Universidad de Queensland y Soo Jen Low, Compañero de investigación post-doctoral, La Universidad de Queensland.
Este artículo se vuelve a publicar desde La conversación bajo una licencia Creative Commons. Leer el artículo original.
.
