
La Administración de Alimentos y Medicamentos está modificando su reciente y controvertida aprobación de un nuevo medicamento para la enfermedad de Alzheimer. La agencia ahora recomienda que el medicamento, llamado Aduhelm y desarrollado por Biogen, solo debe administrarse a personas en las primeras etapas de la enfermedad neurodegenerativa en última instancia fatal. La decisión influirá en gran medida en la cobertura del seguro del tratamiento, que se espera cueste $ 56,000 al año.
La medida se produce apenas un mes después de que la agencia aprobara por primera vez el medicamento. en contra de las recomendaciones de un panel externo que revisado la evidencia del ensayo clínico. Desde entonces, investigadores y legisladores han criticado la FDA, y algunos calificaron la aprobación como la peor decisión de este tipo tomada en la historia reciente.
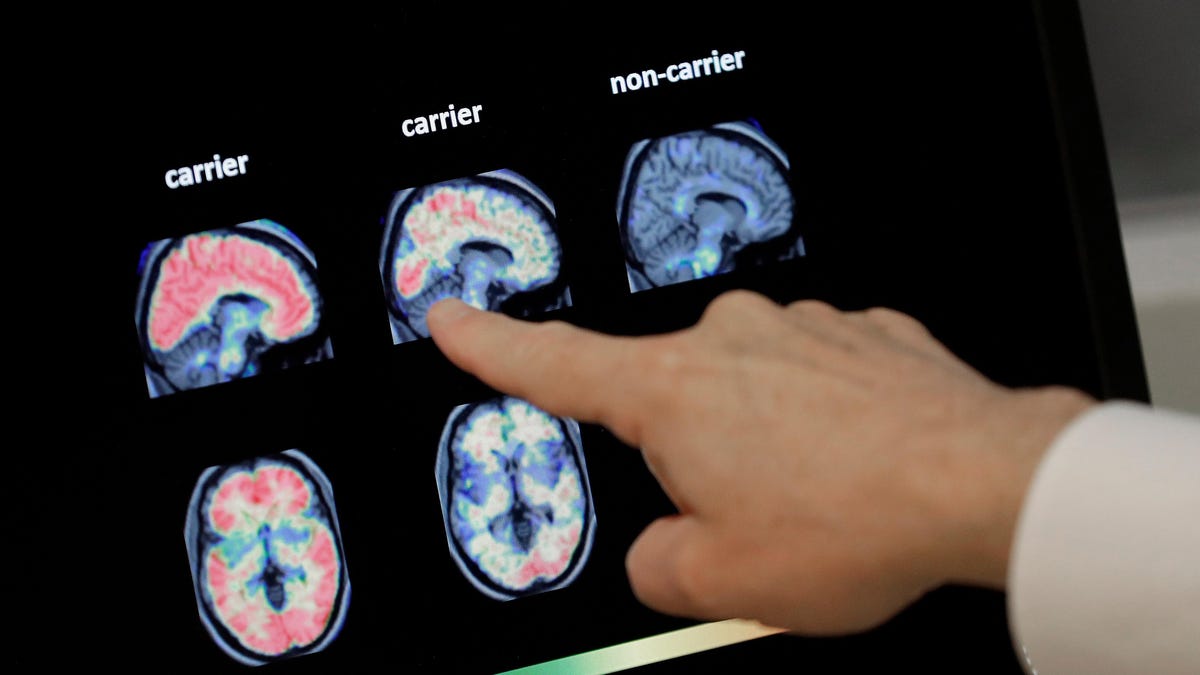
Entre otras cosas, los críticos han puntiagudo a los datos mediocres que respaldan los beneficios de Aduhelm, con solo un ensayo que encontró evidencia estadísticamente significativa de un deterioro cognitivo más lento en los pacientes, y solo en aquellos que tomaron la dosis más alta (el segundo ensayo no encontró una disminución general más lenta pero posiblemente algún efecto no significativo enpacientes dosis).
Otra crítica importante a la aprobación de la FDA se refería a la elegibilidad del medicamento. A pesar de que solo se han realizado pruebas para personas con deterioro cognitivo leve o sospecha temprana de Alzheimer, la FDA indicó originalmente que se recomendaría para cualquier paciente, sin importar qué tan avanzado esté su enfermedad. estaba. El idioma alimentado le preocupa que el uso generalizado de la posible ineficacia El medicamento abrumaría a los pagadores públicos como Medicare, que brinda cobertura de salud a la mayoría de los 5 millones de estadounidenses estimados en la actualidad.viviendo con Alzheimer. Ahora, la FDA está retirando su respaldo general.
“Desde que la agencia aprobó Aduhelm, los prescriptores y otras partes interesadas han expresado confusión con respecto a la población destinada al tratamiento”, dijo el portavoz de la FDA, Michael Felberbaum. dijo los New York Times.
G / O Media puede obtener una comisión
En su ahora actualizado en la etiqueta de prescripción del medicamento, la FDA recomienda que Aduhelm se “inicie en pacientes con deterioro cognitivo leve o en etapa de demencia leve de la enfermedad, la población en la que se inició el tratamiento en ensayos clínicosls. ” Según el NYT, la FDA buscó el cambio, y Biogen acordó enviar un lenguaje revisado. Anteriormente, la compañía afirmó que solo comercializaría el medicamento a pacientes con early Alzheimer.
Los médicos pueden recetar medicamentos fuera de etiqueta, lo que significa que los pacientes con enfermedad de Alzheimer más avanzada todavía puede obtener acceso a Aduhelm. Pero es casi seguro que las compañías de seguros y pagadores como Medicare adoptarán ampliamente el nuevo etiquetado para determinar cobertura para Aduhelm.
Esta decisión no resolverá la controversia sobre la aprobación del fármaco, que algunos científicos temen Desalentar la investigación de otros tratamientos potencialmente más efectivos.. Más recientemente, STAT News ha informó en una colaboración de larga data entre ciertos funcionarios de la FDA y Biogen antes y durante el proceso de aprobación, que incluyó discusiones para enviar el medicamento a través de una vía menos rigurosa para su aprobación. En respuesta, legisladores como la representante Katie Porter (D-CA) han llamada para una investigación formal sobre la FDA por parte de la Oficina del Inspector General, una agencia de control del gobierno.
.
