El jueves, la Administración de Drogas y Alimentos tomó una decisión que probablemente tendrá un gran impacto en el panorama de la investigación de la enfermedad de Alzheimer. La agencia emitió una aprobación tradicional a toda máquina del fármaco Leqembi, desarrollado por las empresas Eisai y Biogen. El fármaco es el primero de su clase en recibir tal aprobación y está destinado a ralentizar la progresión de la enfermedad neurodegenerativa.
Leqembi es uno de varios medicamentos basados en anticuerpos que se dirigen beta amiloide, una proteína que juega un papel importante en la enfermedad de Alzheimer. En las personas con la enfermedad, una forma mal plegada de amiloide se acumula en el cerebro con el tiempo, lo que provoca el desarrollo de grupos resistentes llamados placas. Se cree que estas placas, junto con la acumulación de otra proteína mal plegada llamada tau, ayudan a destruir gradualmente el cerebro. Al descomponer o prevenir la formación de placas, se espera que estos medicamentos puedan detener o retardar el deterioro cognitivo de las personas.
En enero de 2023, la FDA emitido una aprobación acelerada de Leqembi. Este tipo de aprobación permite a las empresas presentar solo evidencia indirecta de que su medicamento será clínicamente significativo para los pacientes, en este caso, la reducción de la placa amiloide. Pero las empresas aún deben recopilar datos y, finalmente, confirmar los beneficios clínicos de un medicamento para recibir aprobación tradicional. Y parece que Leqembi ahora ha alcanzado ese punto de referencia.
“La acción de hoy es la primera verificación de que un fármaco dirigido al proceso patológico subyacente de la enfermedad de Alzheimer ha demostrado un beneficio clínico en esta enfermedad devastadora”, dijo Teresa Buracchio, directora interina de la Oficina de Neurociencia del Centro de Evaluación e Investigación de Medicamentos de la FDA, en a declaración lanzado el jueves.
En el ensayo clínico fundamental de 18 meses de duración que obtuvo la aprobación de Leqembi, se descubrió que el fármaco ralentizaba la progresión del deterioro cognitivo en un 27 % en pacientes en comparación con los que tomaban placebo. Los pacientes también se desempeñaron mejor en las pruebas de su funcionamiento diario y tenían niveles más bajos de amiloide en sus cerebros..
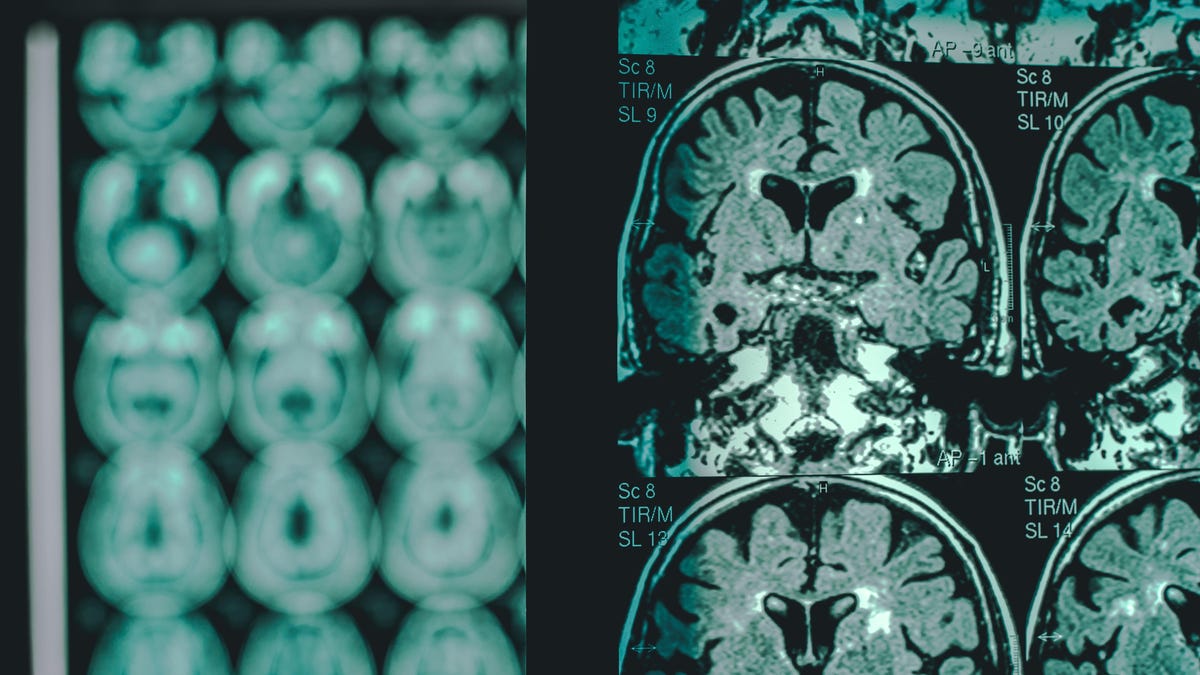
Los medicamentos antiamiloides no están exentos de efectos secundarios, sin embargo. Una de las complicaciones más comunes es conocidas como anomalías en la imagen relacionadas con el amiloide (ARIA), que pueden diagnosticarse mediante resonancia magnética. Las ARIA tienden a ser causadas por una inflamación temporal en el cerebro, pero a veces pueden ser un signo de sangrado potencialmente mortal. La mayoría de los casos de ARIA se resuelven sin problemas, y muchos pacientes no experimentan síntomas, pero ha habido varias muertes relacionadas con las ARIA y estos medicamentos.
El riesgo de ARIA y ARIA grave parece ser mayor en aquellos que portan una mutación particular relacionada con el Alzheimer llamada ApoE ε4. El uso de anticoagulantes también podría ser otro factor de riesgo de hemorragia cerebral grave en estos pacientes. Como resultado, la etiqueta del medicamento requerirá que los médicos analicen el estado de ApoE ε4 de los pacientes antes de prescribirlo. y recomendará precaución adicional al considerar su uso en aquellos que toman anticoagulantes.
La tradicional aprobación de Leqembi sorteará una polémica en torno a estos fármacos antiamiloides. En junio de 2021, la FDA emitió una aprobación acelerada al fármaco Aduhelm, también desarrollado por Biogen y Eisai. Los datos que respaldaban la aprobación de Aduhelm eran decididamente débiles y muchos expertos externos (incluida la mayoría de los designados por la FDA para asesorar a la agencia) protestaron por la decisión. Eventualmente, Medicare dictaminó que no cubriría rutinariamente Aduhelm y medicamentos similares con aprobación acelerada hasta que se reuniera evidencia clara de sus beneficios. La FDA fue más tarde duramente criticado por los legisladores por su aprobación “irregular” de la droga, y los fabricantes de la droga tienen planes retrasados para buscar la aprobación en otra parte.
Aunque es posible que Aduhelm nunca reciba la aprobación completa de la FDA y la cobertura de seguro de rutina, la nueva política de Medicare ya no se aplicará a Leqembi. El precio de lista actual de la droga ($26,000 al año) también es la mitad del precio inicial de Aduhelm, otro factor que alimentó las críticas generalizadas a este último. Dicho esto, algunos investigadores han continuado para argumentar que los beneficios clínicos de Leqembi probablemente sean demasiado modestos para que los pacientes y los médicos estén muy entusiasmados por el momento. Pero la clase de drogas parece estar mejorando. A principios de mayo, el donanemab de Eli Lilly proporcionó los mejores resultados de su tipo vistos hasta ahora, reduciendo la tasa de deterioro cognitivo de las personas en un 35% en comparación con un placebo en un ensayo a gran escala.
